ECOENDOSCOPIA CON PUNCIÓN (PAAF) Y TUMORES QUÍSTICOS DEL PÁNCREAS
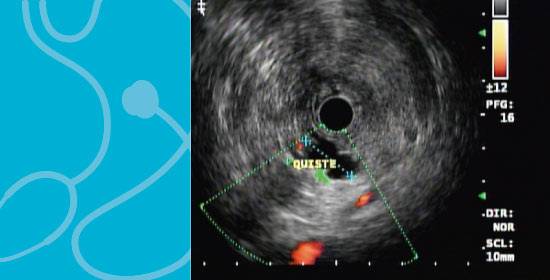
La ecoendoscopia con punción ( PAAF) en los tumores quísticos pancreáticos comprenden una gran gama de variedades cada día encontradas con mayor frecuencia debido a la mayor utilización de técnicas diagnósticas como la tomografía abdominal y la resonancia nuclear magnética. Las lesiones quísticas del páncreas incluyen lesiones tumorales o neoplásicas y las no tumorales.
El ultrasonido o Ecografia endoscópica con punciòn con aguja fina y anàlisis en Colombia se ha convertido en la prueba que mejor caracteriza o defina estas lesiones ya que permite diagnósticas lesiones pequeñas menores de 10 mm; y además del estudio morfológico permite el estudio del líquido obtenido mediante punción; lo anterior es muy importante pues evita la realización de cirugías innecesarias.
La prevalencia de las lesiones quísticas pancreáticas (LQP) aumenta así mismo con la edad ocurriendo en el 10% de los pacientes mayores de 70 años; la mayoría de estas lesiones son asintomáticas y se detectan de forma incidental. Se ha descrito una frecuencia de hasta el 14% de los pacientes a quienes se les realiza una RMN con indicación diferente a estudio del páncreas. Las dos ventajas de la eco endoscopia es que permite identificar lesiones de pequeño tamaño ; en un estudio español reciente describe una tasa del 22% en la detección de LQP cuando se realiza con una indicación no relacionada al páncreas constituyéndose en el examen más sensible en la detección de estos lesiones y con la punción y aspiración con aguja fina ( USE PAAF ) con citología ( rendimiento solo 50% ) , cito químico , estudio macroscópico del liquido obtenido . Utilizando las tres pruebas: viscosidad citología y antígeno carcinoembrionario (ACE) es mas específico (hasta 90.9 %)
La importancia de la identificación correcta de estas lesiones quísticas radica en el potencial de malignidad que presentan algunas como son : los tumores quísticos pseudopapilares, las neoplasias sólidas con degeneración quística y los quistes del tipo mucinosos incluyendo en estos últimos las neoplasias quísticas mucinosas (NQM), la neoplasia mucinosa papilar intraductal (IPMN) . Estos últimos pueden ser de conducto principal ( MD- IPMN) , de rama lateral ( BD-IPMN) o mixtos. Todas ellas presentan un grado potencial de malignizarse que oscilan entre el 10% al 68% siendo los MD- IPMN los de mayor potencial de presentan transformación en cáncer.
Por el contrario los quistes serosos, los quistes simples y los linfoepiteliales se consideran quistes benignos muy rara vez se transforman en malignos casi casos anecdóticos.
El cáncer de páncreas es una de las causas más frecuentes de muerte relacionada con cáncer y al momento del diagnóstico por lo general la mayoría son irresecables por lo que presentan mal pronóstico ( solo 1 de 5 son llevados a cirugía posterior a su diagnóstico ) . La sobrevida a 5 años en occidente es de solo el 5%.
No obstante las lesiones precursoras requieren un promedio de 11,7 años para evolucionar a malignidad y tardan otros 6,8 años adicionales en llegar a presentar metástasis por lo que existe un espacio de tiempo o ventana diagnóstica suficiente para detectar estas lesiones tempranamente.
¿Qué hacer si tengo un quiste pancreático ?
El primer paso es diferenciar entre pseudoquiste y tumor quístico pancreático (NQP) y esto se consigue combinando una buena historia clínica, antecedentes de pancreatitis, características por imagen TC multicorte, RMN y ultrasonido endoscópico (USE) y análisis del líquido citológico, bioquímico e incluso análisis molecular muestra que se puede obtener a través de una punción con aguja fina y aspiración ( FNA o PAAF ) a través de una ecografía endoscópica.
Aspectos morfológicos que permiten definir las lesiones quísticas pancreáticas por imágenes ( TC-RMN y USE ) :
- Identificar lesiones pancreáticas sólidas de pequeño tamaño ; afectación del conducto pancreático principal (CPP) ; comunicación con éste. (RMN y Ultrasonido endoscópico )
- Presencia de septos o de nódulos murales ( RMN y Ecoendoscopia )
- Invasión local de estructuras ( TC o TAC y Ultrasonido endoscópico )
- Metástasis a Distancia ( TAC o TAC multicorte )
La precisión diagnóstica para determinar el tipo de quiste es del 40%-95% para la RM/Colangio-RM y del 40%-81% para el TAC.
La ventaja del USE , con respecto a las otras técnicas de imagen, es la posibilidad de realizar PAAF y obtener muestra para estudio, lo que podría aumentar la eficacia diagnóstica. La rentabilidad de la USE-PAAF es las lesiones solidad pancreáticas está ampliamente demostrada (90%), en cambio los resultados de la citología en LQP son inferiores (50%), por lo que su utilidad es más discutida. Debido a la baja rentabilidad de la citología, múltiples estudios han analizado diversos parámetros en el líquido quístico (viscosidad, marcadores tumorales)
La ecoendoscopia ( ultrasonido endoscópico ó USE ) permite valorar los criterios morfológicos y la realización de punción y análisis del liquido; las características endosonográficas que se han relacionado con malignidad son :
1. El tamaño superior a 3 cm . ( sensibilidad del 74% y especificidad del 49% para el diagnóstico de neoplasia avanzada )
2. La presencia de componente sólido;
3. Engrosamiento mural
3. La dilatación del Wirsung
4. El cambio abrupto del calibre del CPPP ,
5. Atrofia distal de la glándula pancreática
6. La presencia de linfadenopatías
7. El ultrasonido endoscópico con elastografía es de ayuda en la evaluación de las lesiones sólidas del páncreas.
8. La punción – aspiración con aguja fina guida por USE (USE PAAF ó FNA ) es una técnica segura que permite punción y aspiración de su contenido para realizar extracción de células de la lesión y realizar estudio de citología y genético además de determinar análisis bioquímico determinando niveles de amilasa, antígeno carcinoembrionario (ACE), niveles de glucosa y marcadores tumorales que permiten acercarse a una probabilidad estimativa del grado de malignidad aunque conviene resaltar que a pesar del empleo de criterios morfológicos y del análisis citológico y bioquímico, el diagnóstico en ocasiones sigue siendo subóptimo.
Unos niveles bajos de amilasa ( menores de 250 U/L) excluyen el diagnóstico de pseudoquiste con una especificidad del 98%; mientras que unos niveles elevados orientan hacia IPMN o pseudoquiste, aunque al haberse encontrado niveles de amilasa elevados en NQP sin comunicación con el CPP sus niveles no se consideran clínicamente relevantes para ser utilizados en el diagnóstico principal entre diferentes tipos de NQP.
Los niveles de ACE contribuyen a diferenciar lesiones mucinosas de no mucinosas, pero el punto de corte óptimo no ha sido establecido. El más empleado es 192 ng/ml. Con una sensibilidad del 73%, especificidad del 84% y precisión diagnóstica del 79%.
Recientemente se ha publicado estudios que describen que los quistes de estirpe mucinosa contienen niveles inferiores de glucosa que aquellos no mucinosos con una sensibilidad del 95% y especificidad del 57% de especificidad y del 88% y 78% respectivamente con glucómetro con 50 mg/dl como punto de corte . Los niveles de glucosa no se han asociado con malignidad.
Recientemente tras una reunión realizada en Sendai de la IAP realizada en 2016 se presta especial interés a la importancia de nódulos murales y se recomienda cirugía en caso de certeza de nódulo mayor de 5 mm en la USE por según hallazgo seriamente relacionado con malignidad; además de recomendar el seguimiento continuo de los IPMN.
Las guías IAP y europeas conllevan un mayor número de cirugías innecesarias, mientras que si se hubiesen seguido las recomendaciones de la AGA se habría evitado la cirugía en un 28%, aunque un 12% de las lesiones con displasia de alto grado o invasivas no se habría detectado, lo que demuestra una pérdida de sensibilidad de la AGA para la detección de malignidad.
La progresión de células pancreáticas ductales normales a células tumorales se caracteriza por el acumulo de mutaciones genéticas. El análisis del ADN puede contribuir a la diferenciación entre quistes mucinosos ( premalgnos ) de aquellos no mucinosos y para detectar malignidad. Se han asociado determinadas mutaciones a determinadas neoplasias . Actualmente, las guias de práctica clínica recomiendan la determinación de KRAS y GNAS para la identificación de neoplasias de extirpe mucinosa en aquellos casos en los que existan dudas diagnósticas y en los que su adecuada caracterización pueda modificar el tratamiento.
Otra herramienta que mejora el diagnóstico es la USE. CEH ( ultrasonido endoscópico con contraste ) no disponible aún en América pero si en Europa la cual permite definir la estructuras vascularizadas (nódulos y tabiques) de las no como moco y detritus y diferenciar los tumores quísticos de los pseudoquistes puesto que los últimos presentan ausencia de captación de todas las fases salvo aquellos pseudoquistes recientes en los que la cápsula puede realzar. La adecuada detección de nódulos murales es subóptina con TAC, RM y USE .En u estudio reciente de 70 pacientes en el que se disponía de pieza quirúrgica se evaluó la precisión de la USE y USE-CEH realizadas en forma preoperatoria y encontraron que la USE-CEH es superior frente a la USE en modo B para determinar si la presencia de nódulo mural se asocia con malignidad ( respectivamente sensibilidad : 97% vs 97%; especificidad; 75% frente a 40 % y precisión y 84% vs 64 % ) ( 35% más específica y 20% más precisa ) . Se concluyó que los nódulos murales con una altura mayor de 4 mm detectados con USE-CEH se asociaban con malignidad vs en caso de medirse con USE modo B el tamaño debe ser igual o mayor de 8 mm).
¿Debo recibir tratamiento si tengo un tumor quístico del páncreas?
Indicaciones de Cirugía de Tumores o neoplasias quísticas del páncreas:
1. Los tumores o neoplasias quísticas del páncreas SINTOMATICAS deben operarse.
2. Los tumores o neoplasias del páncreas con malignización o quistes de alto riesgo de malignización ( lo difícil es detectar correctamente estos pacientes ) deben ser llevados a cirugía si aún son resecables.
3. Los pseudoquistes y las neoplasias quísticas serosas (NQS) presentan un potencial de malignidad nulo o muy bajo por lo que el tratamiento solo se recomienda en casos sintomáticos o cuando existan dudas del diagnóstico.
4. La Guías Fukuoka , europea y AGA recomiendan el tratamiento quirúrgico de las NQM ( mucinosos ) , la neoplasia sólida pseudopapilar, los MD-IPMN e IPMN mixtos debido al riesgo de malignizarce siempre que el paciente sea candidato quirúrgico.
5. Existe controversia en los casos de BD-IPMN (de rama lateral ) y la conducta no es muy clara .
¿Cómo debe ser el Seguimiento de los tumores o neoplasias quísticas pancreáticas?
Depende del tipo de quiste e implica la evaluación del tamaño y de la morfología en busca de parámetros precoces que sugieran una posible malignización mediante ultrasonido endoscópico o RMN . Los intervalos de seguimiento varían de acuerdo a las diferentes Guías. La guía Fukuoka recomienda seguimiento con RMN o USE con pediodicidad variable en función del tamaño de los quistes, e interrumpir el seguimiento en NQM y NQS resecados en ausencia de neoplasia invasiva. En cambio , la AGA recomienda interrumpir el seguimiento de los quistes pancreáticos tras 5 años en ausencia de cambios y de aquellos NQM, NQS e IPMN resecadas sin displasia de alto grado ni carcinoma invasivo .
Es importante conocer que la simple presencia de una IPMN implica un mayor riesgo de desarrollar cáncer de páncreas que el de la población general, habiéndose descrito un riesgo hasta 19,6 veces superior. Existe riesgo de desarrollar IPMN después de su recepción y de cáncer pancreático metacrónico en el páncreas remanente por lo cual se recomienda seguimiento por largo plazo.
Las neoplasias quísticas pancreáticas son un hallazgo frecuente en pruebas de imagen. Es importante caracterizarlos y estudiarlos dado a su potencial de malignidad que presentan algunas de ellas; en primer instancia debe excluirse el diagnóstico de pseudoquiste y diferenciar entre neoplasias de extirpe mucinosa (IPMN y NQM) y serosa (NQS).
Se deben utilizar no solo criterios clínicos y morfológicos sino también punción con aguja fina con ultrasonido endoscópico ( USE – PAAF ) con análisis citológico y bioquímico, además de análisis molecular en centros especializados para detectar la presencia de malignidad.
En la consulta realizada por gastroenterólogos en Bogotá
Referencias bibliográficas :
1. Raquel Herranz Pérez, Felipe De la Morena López, Cecilio Santander Vaquero . Hospital Universitario de la Princesa. Neoplasias quísticas pancreáticas: enfoque diagnóstico. Diagnostic Approach to Cystic Pancreatic Neoplasms.Revista Colombiana de Gastroenterologia. Vol 34 No 1 Enero-marzo 2019.Pag 52-60.
2. Zikos T, Pham K , Bowen R, Chen Am et al . Cyst Fluid Glucose is Rapidly Feasible and Accurate in Diagnosing Mucinous Pancreatic Cysts. Am J Gastroenterol. 2015; 110 (6): 909-14.
3. Tanaka M, Fernandez-Del Castillo C, Kamisawa T, Jang JY, Levy P. Ohtsuka , et al .Revisions of international consensus Fukuoka guidelines for the management of IPMN of de pancreas. Pancreatology. 2017 ; 17 (5) : 738-753
4. Lekkerkerker SJ, Besselink MG, Busch OR, Verheij J, Engelbrecht MR, et al. Comparing 3 guidelines on the management of surgically removed pancreatic cyst with regard to pathological outcome. GIA 2017; 85(5): 1025-1031.
5. Springer S. Wang Y, Dal Molin M. et al . A combination of molecular markers and clinical features improve tha classification of pancreatic cyst. Gastroenterology . 2015 ; 149 (6) : 1501-10
6.Dumonceau JM, Deprez PH, Lensesen C, Iglesias- Garcia J, Larghi A, Vanbiervliet G. et al. Indications, result, and clinical impact of endoscopic ultrasound (EUS) – guided sampling in gastroenterology: european Society of Gastrointestrinal Endoscopy (ESGE) Clinical Guideline – Updated January 2017 . Endoscopy. 2017 ; 49 (7): 695-714.
7. Farrel JJ, Fernandez – del Castillo C. Pancreatic Cyst neoplams: management and unaswered questions. Gastroenterology. 2013; 144(6): 1303-15.J gastro . 2013.
8. Tanaka M, Fernandez-del Castillo C, adsay V, Chari S Falconi M,. etal . International consensus guidelines 2012 for the management of IPMN and MCN of the páncreas. Pancreatology. 2012; 12(3): 183-97.
9. Lennon AM, Ahuja N, Wolfgang CL. AGA Guidelines for the Management of Pancreatic Cyst. Gastroenterology. 2015; 149 (3) : 825.
10. Chernyak V, Flusberg M, Haramati LB, Rozenblit AM, Berllin E, Incidental pancreatic cystic lesions: is there a relationship with the development of pancreatic adenocarcinoma and all-cause mortality ?. Radiology. 2015 ; 274(1): 161-9.
11. Martínez B Martínez Aparicio JR. Prevalence of incidental pancreatic cyst UN upper endoscopic ultrasound. Ann Gastroenterol. 2017;31:90-5
12. Lidia Arguello ET Al . Rendimiento diagnòsticode la punción mediante ultrasonografia endoscópica de las lesiones quísticas del páncreas. Gastroenterologia y Hepatologìa. Elsevier: 2020;43(1):1-8
DR GUILLERMO SEGUNDO PEREZ GONZALEZ Internista – Gastroenterólogo Ecoendoscopista. UOC ( Universidad Abierta de Cataluña ) . España.
Leave a reply
Leave a reply